さて、生体の調節機能を語る上で必ず避けては通れない体液の調節機構について、極力シンプルに説明してみます。
水溶液中の物質の基本的な性質と用語
まず前提知識を確認しておきます。
液体に混ざっている物質が物理化学的にどのような力を受けているか、どのような性質があるのかを知らなければなりません。
浸透圧:
異なる2つの濃度の溶液が接触すると濃度の濃い方へ水が引き寄せられる力のこと。
拡散:
異なる2つの濃度の溶液が透過性の膜を介して接触すると、濃度の薄い方へ溶質が移動する(力の)こと。
電離(イオン化):
ここでは電解質が溶液中においてや融解時に、陽イオンと陰イオンに分かれることとします。化学的にもう少し細かく定義することもありますが、今は必要ありません。
https://kotobank.jp/word/%E9%9B%BB%E9%9B%A2-102833
電離度(イオン化のしやすさ):
電離度は、水に溶けた物質のうちどの程度が電離(イオン化)するのかを示す数値です。
塩化ナトリウムNaClや塩酸HCl、水酸化ナトリウムNaHCO3は電離度1に近く、ほぼ全てが電離します。
これを、電離度が高いといいます。
酢酸CH3COOHや重炭酸イオンHCO3-は電離度0に近く、水溶液中で電離している分子は非常に少ないです。
これを、電離度が低いといいます。
NaHCO3は水溶液中でほとんどがNa+とHCO3-に電離しますが、HCO3-は電離度は低いですがさらに電離することが可能です。
また水の存在のもとでCO2とOH-に変化(化学反応)することができます。
http://mikecat.org/chem/%E4%B8%A1%E6%80%A7%E9%9B%BB%E8%A7%A3%E8%B3%AA%E6%B0%B4%E6%BA%B6%E6%B6%B2.pdf
電気化学的勾配:
電気化学的勾配は2つの要素から構成されます。
1つ目は化学的勾配で、膜を挟んだ溶質濃度の差によって生じます。つまり透過性の膜を挟んだ両側のイオン濃度が不均等であるときには、イオンは高濃度側から低濃度側へ単純拡散によって膜を越えて移動するということです。
2つ目は電気的勾配で、膜を挟んだ電荷の差によって生じます。つまり膜を挟んで電荷が不均等に分布している場合、膜の両側で電荷が均等となるまでイオンの拡散を駆動する力が電位差によって生み出されということです。
また溶液全体の全イオンの電荷を合算すると常にゼロ(電気的中性)になる性質があり、これを電気的中性の原理と言います。ですから、電気的勾配はあくまで膜の内外の電位差のことです。
これら2つの因子の組み合わせによって、膜を越えたイオンの移動が起こります。
PH:
イオンのうちH+とOH-は、PHを決める役割を持っています。H+とOH-は片方が増えると片方が減る性質があり、H+の濃度だけ知ればOH-は自動的に決まります。H+の濃度を簡単に表記しなおしたのがPHです。PH7が中性で、H+とOH-の濃度が等しい状態です。これよりH+が濃い水溶液の状態を、酸性といいます。逆にH+が薄い状態を、塩基性といいます。
https://www.nhk.or.jp/kokokoza/library/2020/tv/kagakukiso/archive/kagakukiso_27.pdf
H+もOH-もイオンですので、PHに関与しない他のイオンと同様に電気化学的勾配の影響をうけますが、PH自体はイオンの移動に関与する駆動力とは無関係です。
PHの変化により、化学反応の速度や方向が影響を受ける事はあります。
「酸」と「酸性」を混同しないよう気をつけてください。「酸」とは水溶液中で水素イオンH+を放出する分子(塩)またはイオンのことで、これが水溶液に入ると電離して水溶液中のH+が増えます。「酸性」とはPH7以下の水溶液の性質のことです。「塩基」と「塩基性」も同様で、「塩基」とはH+を吸収して水溶液中のH+を減らす分子等のことをいい、「塩基性」とはPH7以上の水溶液の性質です。「中性」とはPH7の水溶液の性質です。
ちなみに血液は概ねPH7.4の弱塩基性です。
化学的にはいくつか定義はありますが、ここでは、酸というのは水溶液中で水素イオンH+を放出する物質、塩基というのはその逆で水素イオンH+を吸収する物質と覚えてください。
状況によっては間違いというわけでもないのですが、「酸性の物質」「アルカリ性の物質」などと言う言葉を使うと非常に混乱を招きやすいです。
加えて、「電気的中性」はイオンの電荷の総和がゼロになるということで、これもPHと無関係なので注意してください。
血液の緩衝作用について
細胞で生命活動が行われると、CO2や不揮発性の酸を生じます。これらはH+を遊離し、血中H+が増えるので、血液PHは酸性に傾きます。
PHの変化は生体タンパク質の構造を変えてしまうため、適切な生体内代謝を維持するためにはPHを一定に保っていなければなりません。
ですからこの生命活動で生じたH+を生体外に効率よく排泄する仕組みが必要になります。
何らかの要因でH+が増えてしまったときにH+を吸収し、逆にH+が減ったときに放出するような性質がある水溶液を緩衝液と言います。
緩衝液中ではH+の濃度変化が少なく抑えられるので、PHが変化しにくくなります。
生物の血液にはこのような緩衝作用があります。その反応の主役となる物質により、炭酸-重炭酸緩衝系、リン酸緩衝系、ヘモグロビン緩衝系、蛋白質緩衝系などがあります。
緩衝系の説明
http://www.igaku.co.jp/pdf/1309_resident-01.pdf
体液中の電解質組成と平衡
体液中の電解質組成は以下のようになっています。
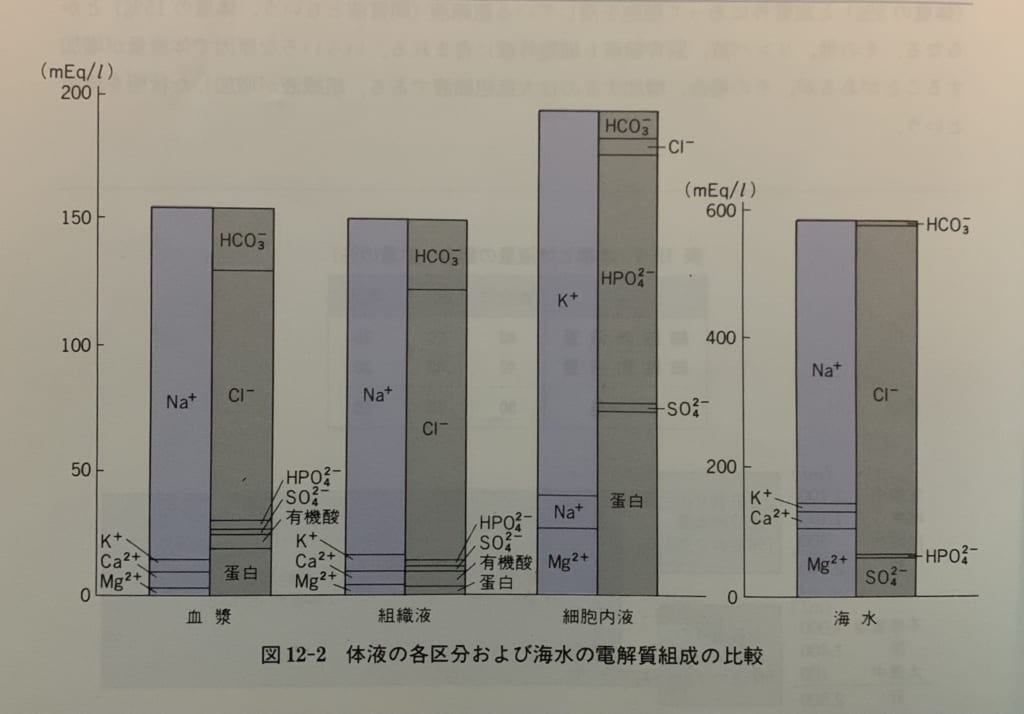
シンプル生理学p282
左から順に、血漿、組織液、細胞内液、海水の順に電解質がどれくらい含まれているかを示しています。
青い棒が陽イオン、灰色の棒が陰イオンで、高さは電解質濃度を示しています。電気的中性の法則に従って、電荷の総和はゼロで平衡するので、同一液内では同じ高さです。
「血漿」は血液の液体部分で、血管内にあります。「組織液」は血管の外ですが細胞にも入っていない液体です。血管壁は水とイオンは通しますが、分子量の大きなタンパク質イオンは通しません。そのため血漿と組織液を比べると、電解質組成はほとんど同じで、血漿のタンパク質イオン濃度のみがやや高くなっています。少し脱線しますが、この濾過されないタンパク質イオン濃度の影響で血管内の浸透圧が組織液より高くなります。この浸透圧差が血圧維持の源です。
一方「細胞内液」は、「細胞外液(血漿と組織液)」とは全く違う電解質組成です。
細胞内液と細胞外液は細胞膜に隔たれており、細胞膜はイオンを選択的に通したり、膜輸送体によって能動的に必要なものを取り込んで不要なものを汲み出したりしているからです。
細胞膜にあるナトリウム-カリウムポンプなどの膜輸送体は、勾配に従って拡散により膜を通過しようとするイオンを勾配に逆らって能動輸送することで、電気化学的勾配を形成(維持)しています。
https://betterlate-thannever.github.io/Chemistry-2e/%E7%AC%AC14%E7%AB%A0-%E9%85%B8-%E5%A1%A9%E5%9F%BA%E5%B9%B3%E8%A1%A1.html
図を見ると、細胞外の陽イオンはNa+が非常に多く、細胞内の陽イオンはK+が非常に多いことがわかります。
細胞外の陰イオンはHCO3-とCl-が主体で、細胞内の陰イオンはタンパク質とHPO42-です。Cl-以外の陰イオンは緩衝作用を持つイオンでしたね。
Na+は細胞外から細胞内には入れません。拡散によって入っても膜輸送体によりすぐに汲み出されるので、事実上入れないように見えます。同様の理由でK+は細胞内から外には出られません。
血管壁と細胞膜の性質の違いによって、体液のどの部分まで液体やイオンが移動できるかどうかが、輸液療法を理解する時に重要になるので、覚えておいてください。
ところで、この図の中にはH+とOH-がありませんね。
そうです。このふたつのイオンは合わせて0.0000014mEq/Lしか存在しないので、省略されてるんですね。だから電解質云々の話には登場しないことがあるんですね。
ここで「平衡」についても理解しましょう。
電解質はただ存在しているのではなく、常に反応したり離れたり、移動したりしているのですが、様々な力学的な影響を受けて、見かけ上この状態を保っているということです。例えばK+が細胞内から常に外に流れ出ていますが、Na‐Kポンプで常に細胞内に引き戻しているため、動いてないように見えることに似ています。化学反応も同様に、ちょうどいいところで止まっているように見えるところが平衡です。
質量作用の法則
質量作用の法則は、「化学反応の速度は反応物の活性または濃度の積に正比例する」という法則で、動的平衡における物質の挙動を説明します。具体的には、平衡状態にある化学反応混合物の場合、反応物と生成物の濃度の比率が一定であることを意味します。
https://en.m.wikipedia.org/wiki/Law_of_mass_action
言葉が非常に難しいのでざっくり言い直すと、
「化学反応は、濃度が濃いと速く進む。」
「平衡状態まで反応が進むと、反応物と生成物の濃度の比率は一定になる」
そして「平衡状態に至る物質の動きを説明する」という法則です。
たとえば炭酸H2CO3は、水溶液中では一定の割合で電離する性質があります。100個のH2CO3が溶けている水では99個はH2CO3の形のまま存在し、1個のみH+とHCO3-に分かれるというような感じです。
ここにH+を放出する酸を投入すると、水溶液中には一旦H+が増加します。H2CO3は一定の割合で電離している状態(ここでは99:1)を保ちたいので、増えたH+とHCO3-が反応しH2CO3の数が増えます。反応がすべて終わって平衡に達すれば、H2CO3とH+の比率は(99:1)に戻るよということです。
さらに例を挙げて「平衡」を解説しようとも考えましたが、喩え話や化学式を用いて解説するのは化学の専門家でも難しいようなのでこれ以上はやめにします。
化学教育における平衡をめぐる理解と誤解について
https://core.ac.uk/download/pdf/147816457.pdf
図示したり喩えたりしても水溶液中での化学反応が進む様子を表現することは難しいし、むしろ誤解を招くことが多いようです。実際私も今まで理解が不十分でした。
結局のところ、目に見えない反応を頭の中にイメージとして形成するためには、化学実験したり化学平衡に関する計算問題や化学式を解いたりして一度は真面目に高校化学に取り組む必要があるようです。
今まで私が酸塩基平衡や電解質についてなんとなく納得できていなかった理由は、自分の中に「平衡」に関するイメージが掴めてなかったからかもしれません。私と同じように、体液についていまいち分からないと感じている人は、質量作用の法則について、きちんと理解するまで取り組んでみてください。
酸塩基平衡の調節について
体液PHは通常7.4で、やや塩基性です。
体液には様々なイオンが存在しますが、PHを決めているのはH+濃度です。H+もイオンのひとつですので、他のイオンと同じように、電気的中性の法則や電気化学的勾配、質量作用の法則などに従って移動したり反応したりします。そのため化学反応を起こす他のイオンもH+の濃度に影響します。
代謝により生体内に酸が増えると、H+が増えることになります。血液PHを一定に保つということは、生命活動を行うほど増えてくるH+を一旦緩衝物質で吸収し、その後うまく体外に排泄するということです。
緩衝物質にはHCO3-、HPO42-、蛋白質(ヘモグロビン等)、有機リン(ATP等)などがあります。
増えたH+はこれらの物質と一旦反応するので、PHは急に変化しません。(緩衝作用)
緩衝により吸収されたH+を排泄する経路は2つあり、肺からCO2として排泄される経路と、腎臓から排泄される経路です。
PHの調節を行う臓器は主として肺と腎臓です。
H+が増えると生体は呼吸を促進してCO2の排泄を増やし、また腎臓からのHCO3-の再吸収とH+の排泄を増やします。
H+が減ると、その逆の反応が起こります。
アシドーシスとアルカローシス
呼吸性アシドーシスというのは、呼気からのCO2排泄が障害されて、結果的にH+の排泄がうまくできない病態のことです。
代謝性アシドーシスというのは、その他の原因でH+を増やす物質が体内に溜まってしまう病態のことです。代謝性というのが分かりにくいので、最近は非呼吸性アシドーシスという言い方をすることもあります。
H+を増やす(遊離する、放出する、与えるなどとも言われます)物質を「酸」といいましたね。
よくある代謝性アシドーシスを起こす酸はケトン体と乳酸です。ケトン体は脂肪代謝が障害された結果で、乳酸は炭水化物代謝が障害された結果で蓄積します。
腎臓のH+排泄障害やHCO3-の再吸収障害でおきたH+増加も、代謝性アシドーシスと言います。
下痢でHCO3-が喪失して起きたH+の増加も代謝性アシドーシスです。
呼吸性アルカローシスは、過換気によってH+を必要以上に排泄してしまう病態のことです。
代謝性アルカローシスは、嘔吐でH+を過剰に失ったり、第四胃変位で胃酸の隔離が起こったりすると起こります。
腎不全の病態のうち、高アルドステロン血症のようにH+を過剰に排泄してしまうときも代謝性アルカローシスです。
アシドーシスとアルカローシスの代償反応
血中H+の変化が起こると、一旦緩衝物質で吸収または放出してPHの変化を抑えますが、緩衝した上でのわずかなPH変化に対処してその代償反応が起こります。
呼吸性の代償反応は直ちに起こり、アシドーシスなら呼吸運動が促進されCO2排泄促進、アルカローシスなら呼吸抑制されCO2を保持します。腎性の代償反応には2-5日を要します。HCO3-の吸収促進と、H+排泄の促進です。
ところでHCO3-って酸塩基平衡の解説によく出てくるんですが、これがなぜH+の増減と関わるのかを説明しときましょう。
通常状態で、H+とHCO3-は平衡状態を保っています。(この平衡にはもちろん他のイオンも影響しますが、この説明内では無視します。)
平衡状態から急にH+濃度が上がると、
HCO3-+H+➝H2CO3➝H2O+CO2
の反応が進むので、結果的に増えたH+はHCO3-を消費してCO2とH2Oになり、HCO3-が減ってPHは元に戻ります。
では急にHCO3-濃度が上がるとどうなるかというと、やっぱり同じ反応が起こり、
HCO3-+H+➝H2CO3➝H2O+CO2
となってH+を消費するのでPHは塩基性に傾きます。
平衡状態からH+が減ると、平衡状態のH+濃度が保てなくなるのでこの反応は逆に進み、
HCO3-+H+←H2CO3←H2O+CO2
となるので血中CO2が豊富にあれば元に戻ります。CO2がない場合はH2OからH+を奪ってOH-が増えるので塩基性に傾きます。
ではこの平衡状態の水溶液にCO2を溶かしてみます。CO2が過剰になると、平衡に戻ろうと反応が進みますので、
HCO3-+H+←H2CO3←H2O+CO2
となり、その結果H+とHCO3-が増えるため水溶液は酸性に傾きます。
CO2自体にH+は含まれていませんが、水溶液中ではH+を増やす性質があります。
というわけで、
血液中にHCO3-を加えると塩基性に傾くし、HCO3-を取り除くと酸性に傾くことになります。
血液中にCO2を加えると酸性に傾くし、CO2を取り除くと塩基性に傾くことになります。
ひとつの式だけを例として挙げました。実際は溶液中に存在している他イオンとのさまざまな化学反応が起こりますが、この反応に関してH+イオンの収支はそうなるよということです。
https://watanabekats.com/2269/
炭酸水素ナトリウムの水溶液が塩基性なのはなぜ?化学反応式を解説
http://mikecat.org/chem/%E4%B8%A1%E6%80%A7%E9%9B%BB%E8%A7%A3%E8%B3%AA%E6%B0%B4%E6%BA%B6%E6%B6%B2.pdf
両性電解質水溶液の水素イオン濃度 電離定数 証明
酸塩基平衡異常を示す病気
次回以降、ここまでの解説を理解した上で、典型的な病態について理解しつつ覚えていきましょう。
頑張って行きましょう。
その他参考
電気的中性の原理【electroneutrality principle】
電解質溶液中の全イオン種の濃度は,溶液全体では常に中性になるように保たれているという原理
https://www.weblio.jp/content/%E9%9B%BB%E6%B0%97%E5%8C%96%E5%AD%A6%E7%9A%84%E5%8B%BE%E9%85%8D
https://www.weblio.jp/wkpja/content/%E9%9B%BB%E6%B0%97%E5%8C%96%E5%AD%A6%E7%9A%84%E5%8B%BE%E9%85%8D_%E9%9B%BB%E6%B0%97%E5%8C%96%E5%AD%A6%E7%9A%84%E5%8B%BE%E9%85%8D%E3%81%AE%E6%A6%82%E8%A6%81
酸塩基平衡についての解説
https://www.jstage.jst.go.jp/article/jjsam1948/17/4/17_4_6/_pdf
pHはなぜ0から14までなのか(pHの疑問いろいろ) 非常に理解を助ける説明
https://science-log.com/%E5%8C%96%E5%AD%A6/ph%E3%81%AF%E3%81%AA%E3%81%9C0%E3%81%8B%E3%82%8914%E3%81%BE%E3%81%A7%E3%81%AA%E3%81%AE%E3%81%8B%EF%BC%88ph%E3%81%AE%E7%96%91%E5%95%8F%E3%81%84%E3%82%8D%E3%81%84%E3%82%8D%EF%BC%89/
二酸化炭素の溶解と酸塩基平衡 (1) -大気との平衡
http://ftacg.livedoor.blog/archives/26517389.html